Para que servem os gases nobres?
Para que servem os gases nobres
Gases nobres, raros ou inertes: com certeza você já ouviu falar deles. Gases como o Hélio, Argônio e Neônio são comuns em aplicações corriqueiras, como lâmpadas, luminosos e bexigas de festas. Outros, como o Criptônio e o Radônio não são tão comuns – e podem ser até mesmo perigosos.
Mas afinal, para que servem esses gases? Se são inertes, como podem ter alguma aplicação prática? É o que vamos ver a seguir.
Mas antes, precisamos saber o que é um gás nobre.
O que é um gás nobre?
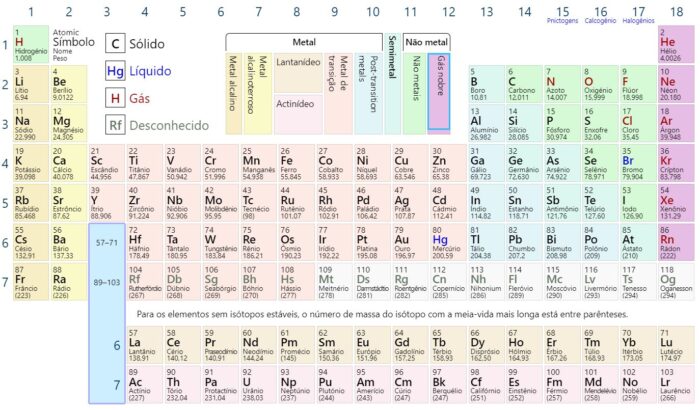
Os gases nobres, também chamados de gases raros ou gases inertes, são os 7 elementos químicos do grupo 18 na tabela periódica que possuem a principal propriedade de não reagir com outros elementos químicos (com raras exceções), sendo basicamente inertes.
Isso ocorre devido à configuração eletrônica desses elementos (que são gases): seus átomos possuem a camada de valência totalmente preenchida, sem a tendência de aceitar ou doar elétrons para formar ligações químicas.
Os gases nobres são:
- Hélio (He)
- Neônio (Ne)
- Argônio (Ar)
- Criptônio (Kr)
- Xenônio (Xe)
- Radônio (Rn)
- Oganessônio (Og)
Tanto o radônio quanto o oganessônio possuem apenas isótopos radioativos.
O oganessônio é um elemento produzido artificialmente (sintético), em quantidades ínfimas (alguns átomos) com meia-vida de apenas 0,7 ms, e por conta disso ainda não foi possível saber ao certo sua fase (estado físico). Provavelmente ele será um elemento sólido em temperatura ambiente, com propriedades reativas, ao contrário dos demais gases raros – talvez não sendo então considerado um gás nobre.
Se esses elementos não reagem com outros, não formam compostos nem participam de reações químicas, para que eles servem? Na verdade, os gases inertes tem vários usos, como veremos a seguir.
Os gases nobres encontram diversas aplicações na indústria, como por exemplo a formação de atmosferas inertes para soldagem, proteção de amostras e para impedir que reações químicas ocorram. Também são empregados na fabricação de lâmpadas e lasers, além de aplicações em equipamentos hospitalares, de mergulho, e outros.
Aplicações dos gases nobres
Os gases raros encontram diversas aplicações científicas, na indústria, medicina e entretenimento. A seguir destaco algumas das aplicações mais comuns para cada elemento químico do grupo 18 da tabela periódica – os gases nobres naturais mais o oganessônio.
Aplicações do gás Hélio
O nome Hélio vem de Helios, deus do Sol na mitologia grega, pois o elemento foi descoberto primeiramente na atmosfera do Sol, antes de ser encontrado aqui na Terra.
Possui os pontos de fusão e ebulição mais baixos de todos os elementos químicos, e é o segundo elemento mais leve e mais abundante no Universo, após o Hidrogênio. Na atmosfera terrestre está presente em concentrações muito baixas, da ordem de 0,0005% apenas.
O gás hélio encontra diversos usos, tais como mistura de gases para cilindros de mergulho, o que ajuda a evitar problemas como a narcose por nitrogênio (doença da descompressão) em mergulhadores de profundidade.

É empregado também como material criogênico, sendo um excelente refrigerante usado em vários tipos de máquinas e processos, desde aceleradores de partículas e o LHC (Grande Colisor de Hádrons, no CERN) até a fabricação de ímãs supercondutores para máquinas de imagem por ressonância magnética (MRI)
Também é usado na fabricação de lasers, em conjunto com o gás neônio, em equipamentos de análise por cromatografia gasosa, na construção de balões dirigíveis (por ser mais leve que o ar) e, é claro, para encher bexigas (balões de gás) usados em decoração para festas.
Aplicações do gás Neônio
Cerca de 0,0018% da atmosfera terrestre é formada por neônio (ou néon), porém este gás é o 5° elemento mais abundante no Universo, logo atrás do carbono.
Seu principal uso é na fabricação de tubos de descarga e sinais luminosos (luminosos de neon). Um tubo contendo o gás é percorrido por uma corrente elétrica, fazendo com que o elemento emita uma luz bem característica, de cor vermelho alaranjada.
Também é empregado na fabricação de lasers, geralmente em conjunto com o gás hélio.

Além disso, o neônio é um material criogênico, usado em aplicações que requeiram refrigeração extrema.
Aplicações do gás Argônio
O argônio é o gás nobre mais abundante na atmosfera terrestre, sendo o terceiro gás em termos percentuais, mais comum que o gás carbônico. Em torno de 0,93% da atmosfera da Terra é gás argônio. A maior parte desse argônio é oriunda do decaimento radioativo de isótopos de potássio na crosta terrestre.
É amplamente empregado em soldas de arco, para criar uma atmosfera inerte sem oxigênio ao redor do ponto de soldagem, protegendo-o contra oxidação enquanto solidifica.

Também é usado na fabricação de lâmpadas incandescentes (caindo em desuso, e não mais fabricadas em muitos lugares) e lâmpadas fluorescentes. Além disso, encontra aplicação na indústria de semicondutores, em processos de criação de cristais semicondutores de germânio e silício, usados na fabricação de componentes eletrônicos diversos.
Aplicações do gás Criptônio
O nome criptônio vem da palavra grega kryptos*, que significa “oculto, escondido”, e ele compõe em torno de 0,0001% da atmosfera terrestre.
É usado na fabricação de flashes fotográficos e faróis, assim como o criptônio, e também em sinais luminosos, neste caso emitindo uma luz verde brilhante.

* de onde também vem a palavra criptografia.
Aplicações do gás Xenônio
O xenônio é um gás bastante raro, encontrado em concentrações de cerca de 0,0000087% na atmosfera.
É empregado na fabricação de flashes fotográficos e luzes estroboscópicas, emitindo um brilho intenso ao ser percorrido por corrente elétrica dentro de um tubo selado.

Também é empregado na fabricação de lâmpadas para esterilização, pois emite luz em comprimentos de onda capazes de destruir vírus e bactérias na superfície de objetos e no ar.
Além disso, é um componente importante na fabricação de lasers de rubi, muito empregados em aplicações médicas.
Aplicações do gás Radônio
O radônio é um gás radioativo, encontrado em quantidades diminutas na atmosfera. Seu isótopo mais estável, o Rn-222 tem uma meia-vida de apenas 3,8 dias, o que torna esse elemento muito raro.
É formado naturalmente de forma direta por decaimento radioativo do elemento Rádio e pelo decaimento de outros elementos, com o Urânio e o Tório.
Por ser um elemento gasoso, pode ser inalado facilmente, podendo ocasionar graves problemas de saúde por ser radioativo. De acordo com o EPA (Agência de Proteção Ambiental dos EUA), o radônio é a segunda causa mais frequente de câncer de pulmão, logo após o cigarro, causando em torno de 21.000 mortes por ano só nos EUA.
Ainda assim, o elemento encontra algumas aplicações importantes, como em terapias contra o câncer, para matar tumores em radioterapia, e no tratamento (controverso) de outras doenças, como artrite e doenças inflamatórias.
Oganessônio
O elemento Oganessônio é na verdade um metal, porém pertence à família dos gases nobres devido à sua localização na tabela periódica. Trata-se um elemento criado artificialmente, em minúsculas quantidades (poucos átomos apenas), e tem o maior número atômico (118) e número de massa (294) de todos os elementos químicos conhecidos.
O nome Oganessônio é uma homenagem ao cientista russo Yuri Oganessian, e seu único uso atual é em pesquisas.
Perguntas
- Quais são os elementos chamados de gases nobres?
Os elementos que constituem o grupo dos gases nobres ou raros são o Hélio, Neônio, Argônio, Criptônio, Xenônio, Radônio e Oganessônio - Qual o gás nobre mais abundante na atmosfera da terra?
O gás raro mais abundante na atmosfera terrestre é o Argônio, que é mais abundante do que o gás carbônico (CO2), com uma concentração de 0,93%. - Quais gases raros são radioativos?
Os gases raros que somente possuem isótopos radioativos são o Radônio (número 86 na tabela periódica) e o Oganessônio (número 118 na tabela periódica)
Referências
- Emsley, J. Nature´s Building Blocks: An A-Z Guide to the Elements. 1ª Edição. 2001. Oxford University Press
- Enghag, P. Encyclopedia of the Elements. 1ª ed. 2004. Wiley-VCH
- Gray, T. The Elements – A Visual Exploration of Every Known Atom in the Universe. 1ª Edição. 2009. Black Dog & Leventhal Publishers.
- Green, D. The Periodic Table in Minutes: The elements and their chemistry explained in an instant. 1ª Edição. 2016. Ed. Quercus
- Jackson, T.; Challoner, J. The Periodic Table Book – A Visual Encyclopedia of the Elements. 1ª Ed. 2017. Dorling Kindersley Ltd.



